
2.2 定位效應和反應活性
在芳香族化合物發生取代反應時,環上的取代基對取代反應發生的位置和反應進行的速度,都有一定的影響。前一種影響叫取代基的定位效應;后一種影響致使反應進行的比母體芳香環的反應速度大的,叫致活作用;致使反應進行的比母體芳香環的反應速度小的,叫致鈍作用。
2.2.1 一元取代苯中的反應活性和定位效應
當親電取代反應發生在一基取代的苯上時,新基團可能被導入鄰、間或對位,取代比用苯或許更快或許更慢。增大反應速度的基團叫活化基團,使反應速度減慢的基團叫鈍化基團。某些基團主要是間位的,這些基團全是鈍化的;其余主要是鄰對位的,這些基團的某些也是鈍化的,但大多數是活化的。各個基團的定位效應和反應活性,可以根據共振效應和場效應對中間體芳烴正離子的穩定性來作出解釋。
根據以上理論,可以把基團分為三類:
(1)與環相連的碳原子上,有未共享電子對的基團。屬于此類的有:O-,NR2,NHR,NH2,OH,OR,NHCOR,OCOR,SR和四種鹵素。這些基團是鄰對位的。
(2)與環相連的原子上缺少未共享電子對的基團是-I的。屬于此類的基團有:(按鈍化能力減少排序)NR3+,NO2,CN,SO3H,CHO,COR,COOH,COOR,CONH2,CCl3,NH3+。這些基團是間位的。
(3)連到環的原子上缺未共享電子對又是鄰對位的基團。屬于此類的基團為:烷基,芳基和COO-基,這些都是活化苯環的,它們是鄰對位的。
2.2.2 鄰/對比率
當鄰對位基團在芳環上時,到底形成多少鄰位產物和多少對位產物,一般來說是非常難以確定的。它們之間的比例大都是由反應條件決定的,例如甲苯的氯化。影響鄰/對比率的又一重要因素是位阻效應,如或環上基團或進攻基團很大,于是位阻抑制了鄰位產物的形成,這樣增大了對位產物的數量。
當鄰對位基是帶有未共享電子對的基時,還有一種以消耗鄰位產物來增加對位產物的含量的效應。
在某些情況下,由于親電試劑和指示基團之間的相互作用,因而鄰/對比率很高。例如,甲基苯乙醚用五氧化二氮硝化時,鄰/對比率要比用硝酸和硫酸更平常的混合酸硝化時更高。
還有,如果苯環上連接著一個場效應比較大的基團,由于場效應隨著距離的加大而影響減小,因而在鄰位的影響比在對位的大。在鹵素中,氟的-I效應最強,因而和對位相比,氟在鄰位的相對致鈍作用最大,氯次之,溴再次之,碘又次之。這樣,在鹵代苯的親電取代反應中,碘代苯的鄰位產物應該最多,氟代苯的鄰位產物應該最少。
已經證明,通過只從分子模槽對位射進的封閉的基質分子,能發生專位的對位取代。
2.2.3 超過一個取代基的苯環定位
在許多情況下已在環上的基團是互相加強的,此時往往可能預測產物的比例。然而,當這些基團定位彼此相反時,預測產物比例就非常困難了。盡管如此,還是有一些規律的:
(1)如果一個強活化基團與較弱的基團或與鈍化的基團發生爭奪時,前者是控制的。
(2)所有其它條件相同,進入的第三個基團,至少可能在兩個基團之間成間位關系。這種效應與位阻有關。
(3)當間位基團與鄰對位基團成間位時,進入的基團主要是進入間位基團的鄰位,不是在對位。這叫鄰位效應。
2.2.4 其它環系定位
稠環系的位置是不等的,甚至在未取代的烴上也常有一個頂好的定位。雜環化合物的位置也不等,原理類似。當稠環系有取代基時,結合上述原理,常可作出成功的預測。在更迭烴中,在給定的位置的反應性與它的自由價成正比。
2.2.5 基質反應性的定量處理
通常,由于有幾個可以離去的氫在環上的事實,因此芳香取代的定量速率研究非常復雜。因而測定各個反應的總速率并不能反映反應的全貌,這時需要的是每個位置的速率比。這樣我們可以把一定基團和一定反應的分速率因子,規定未在一個位置上相對與苯的一個位置取代的速率。
如果假定取代基的效應是可以加合的,就可以用分速率因子來預測在二元或多元取代苯上形成的產品異構體的比例。
然而,取代基的影響是比較復雜的,空間效應,取代基的共軛效應都在影響進入基團的分布。因而,簡單的應用分速率因子的加合來估計進入基團的分布,會與實際情況不相一致的。
另外一種辦法就是用只有一個離去基團的作用物進行比較以避免由于作用物里離去基團的競爭引起的問題。使用的作用物的離去基團不是氫而是一個其它的基團就可以很容易的達到這個目的。通過這種方法,可以測定反應的總的速率比例。
2.2.6 對親電試劑的反應性的定量處理,選擇性關系
親電試劑的反應能力并不是完全等同的。對此進行處理的最明顯的方法是用Hammett方程:
![]()
但是,Hammett方程用于吸電子基團是相當成功的,用于給電子基團則失敗了。若用Brown σ+值來修正σ值,則可成功解釋給電子基團。但這種方法對鄰位取代則不能應用。
Hammett方程的修改,是Brown根據反應試劑的反應性隨選擇性相反變化的原理提出來的,叫選擇性關系。
Brown規定反應的選擇性Sf為:
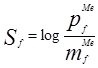
其中,pf和mf分別為對位和間位的分速率因子。
如果把Hammett-Brownσ+ρ關系和logSf及logpfMe之間以及logSf及logmfMe之間的線性關系合并在一起,則得到下列公式:
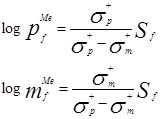
Sf與ρ之間的關系為:
![]()
這些公式和由甲苯的取代反應得到的大量的實驗資料是相符合的。同時,這樣的處理對于其它一些不太容易極化的取代極也是適用的,但對于比較容易極化的基團,則這種關系有時適用,有時不適應。這種關系同樣對很強的親電試劑也不適用。




