
(本中文說明書為翻譯稿,僅供參考,應以英文版為準)
貨號:3091314 (Sigma-Aldrich : GAGO20)
儲存溫度:2-8℃
產品描述:
酶作為一種分析工具,在食品、生化和制藥工業中得到了廣泛的應用。酶的方法是特異性的,可重復的,靈敏的,快速的,因此,是分析目的的理想方法。由于酶的高特異性和敏感性,定量分析可以在很少或沒有樣品準備的情況下進行1-5。
本試劑盒用于食品和其它材料中葡萄糖的定量、酶法測定。各種出版物已經報道了在不同的系統和樣本上使用該試劑盒,包括果蠅6-8、牛糞9、培養的小鼠肌肉細胞10、HEPG2細胞11和水生生物12。
原理:
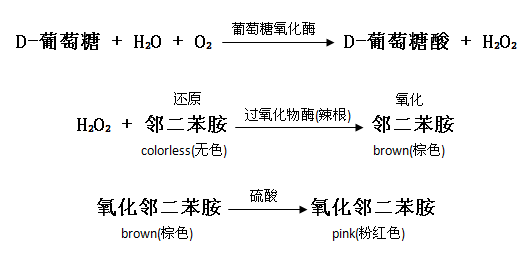
• 葡萄糖氧化酶將葡萄糖氧化成葡萄糖酸和過氧化氫。
• 過氧化氫在過氧化物酶的存在下與鄰二苯胺反應生成有色產物。
• 氧化的鄰二苯胺與硫酸反應生成更穩定的有色產品。
• 在540 nm處測得的粉紅色的強度與原始葡萄糖濃度成正比。
試劑盒組成:
1、葡萄糖氧化酶/過氧化物酶試劑
• 將未打開的試劑盒試劑保存在2-8℃。每個膠囊包含500單位的葡萄糖氧化酶(黑曲霉),100單位(purpurogallin units)的過氧化物酶(辣根)和緩沖鹽。
• 將膠囊內容物倒入琥珀色的瓶子中。
• 將這些物質溶解在39.2 mL去離子水中。
• 該溶液在2-8℃最多穩定一個月,在-20℃冷凍至少六個月。
• 如果出現渾濁,請丟棄。
2、鄰二苯胺試劑
• 將未打開的試劑盒試劑保存在2-8℃。盡量減少曝光。預先稱量的小瓶中含有5毫克的鄰二苯胺鹽酸鹽。
• 用1.0 mL的去離子水重新配制鄰二苯胺小瓶的內容物。
• 翻轉樣品瓶幾次以溶解。
• 避免將試劑暴露在光線下。
• 溶液在2-8℃下穩定3個月。
3、分析試劑
• 向裝有39.2 mL葡萄糖氧化酶/過氧化物酶試劑的琥珀瓶中加入0.8 mL鄰二苯胺試劑。
• 將瓶子倒過來幾次混合。
• 盡量減少暴露在光線下。
• 溶液在2-8℃下穩定1個月。
• 如果出現渾濁或其他顏色,請丟棄。
4、葡萄糖標準溶液
• D-葡萄糖,在0.1%的苯甲酸中為1.0 mg/mL。
• 該標準可追溯到NIST標準,并提供即用型。
• 在2-8℃穩定至少六個月。
• 如果出現混濁,請丟棄。
必需但未提供試劑:
硫酸,ACS試劑,為18M硫酸試劑。在去離子水中準備6M溶液。
儀器:
1、分光光度計或比色計:可在540nm下測定吸光度。
2、比色皿。
3、試管,18 mm×150 mm
4、移液器:能夠準確分配20 μL至2.0 mL的體積。
5、能保持溫度在37℃的水浴鍋
注意事項和免責聲明:
本試劑僅供科研使用,不能用于藥品、家庭以及其他用途。有關危險和安全操作規程的信息,請參閱安全數據表。
操作步驟:
樣品制備:
液體:
• 用去離子水將樣品稀釋至葡萄糖濃度為20-80μg/mL。
• 如有必要,對溶液進行過濾或去蛋白處理以使其澄清。
• 樣品葡萄糖含量較低且顏色較深時,應予以脫色處理。
• 含碳酸或發酵樣品,須脫氣處理。
固體:
• 稱量0.1mg樣品。
• 用去離子水提取樣品。可以將溶液加熱(<75℃)以幫助萃取。
• 用去離子水稀釋提取液品至葡萄糖濃度為20-80μg/mL。
• 如有必要,對溶液進行過濾或去蛋白處理以使其澄清。
測定:
方法1:標準曲線中的葡萄糖濃度
1、吸取以下溶液到相應的試管中:
| 試管 | 水(ml) | 樣品(ml) | 葡萄糖標準溶液(ml) |
| 空白試劑 | 1.00 | - | - |
| 1# 試管 | 0.98 | - | 0.02 |
| 2# 試管 | 0.96 | - | 0.04 |
| 3# 試管 | 0.94 | - | 0.06 |
| 4# 試管 | 0.92 | - | 0.08 |
| 測試 | - | 1.00 | - |
2、計時起點,通過向第一個試管中加入2.0 mL的測定試劑開始反應并混合。在向每個后續試管中添加測定試劑之間,要間隔30至60秒。
3、讓每個試管在37℃下反應30分鐘。通過在每個試管中加入2.0 mL的6M硫酸溶液,以30-60秒的間隔停止反應。小心地將各管徹底混合。
4、在540 nm處測量每個試管對空白試劑的吸光度。
方法2:單一標準品中的葡萄糖濃度
1、吸取以下溶液到相應的試管中:
| 試管 | 水(ml) | 樣品(ml) | 葡萄糖標準溶液(ml) |
| 空白試劑 | 1.00 | - | - |
| 1# 試管 | 0.95 | - | 0.05 |
| 測試 | - | 1.00 | - |
2、計時起點,通過向第一個試管中加入2.0 mL的測定試劑開始反應并混合。在向每個后續試管中添加測定試劑之間,要間隔30至60秒。
3、讓每個試管在37℃下反應30分鐘。通過在每個試管中加入2.0 mL的6M硫酸溶液,以30-60秒的間隔停止反應。小心地將各管徹底混合。
4、在540 nm處測量每個試管對空白試劑的吸光度。
結果:
計算方法1:
對于標準品,繪制540 nm處的吸光度(y軸)與葡萄糖的毫克含量(x軸)標準曲線。如果標準曲線不是線性的,則結果將不準確。重復測定。
對于測試,從標準曲線確定葡萄糖毫克數。
將上面確定的毫克葡萄糖乘以樣品制備中的稀釋倍數。
計算方法2:

將上面確定的毫克葡萄糖乘以樣品制備中制備的稀釋倍數。
參考文獻:
1、Bergmeyer, H.U. and Bernt , E., Methods of Enzymatic Analysis (H.U. Bergmeyer, ed.). Academic Press (New York, NY), 2nd ed., pp. 1205-1212 (1974).
2、Official Methods of Analysis, 16th Edition. AOAC International, Sections 32.2.05 and 44.7.12 (1995).
3、Raabo, E. and Terkildsen, T.C., Scand. J. Clin. and Lab. Invest., 12(4), 402-407 (1960).
4、Southgate, D.A.T., Determination of Food Carbohydrates. Applied Science Publishers, Ltd. (London, 1976).
5、Washko, M.E. and Rice, E.W., Clin. Chem., 7(5), 542-545 (1961).
6、Wen, Z. et al., Appl. Biochem., Biotechnol., Spring; 121-124, 93-104 (2005).
7、Huang, J.-H. and Douglas, A.E., Biol. Lett., 11(9), 20150469 (2015).
8、Unckless, R.L. et al., G3 (Bethesda), 5(3), 417-425 (2015).
9、Tennessen, J.M. et al., Methods, 68(1), 105-115 (2014).
10、Hien, T.T. et al., J. Biol. Chem., 291(7), 3552-3568 (2016).
11、Whitehead, T.D. et al., J. Nucl. Med., 54(10), 1812-1819 (2013).
12、Hsiao, C.J. et al., Dis. Aquat. Organ., 119(3), 199-206 (2016).




