
分析化學中的四種滴定分析方法,分別是:氧化還原滴定、絡合滴定、酸堿滴定、沉淀滴定。
四種滴定分析方法的區別主要是反應的類型和是否便于測定。比如,氧化還原滴定主要用于氧化還原反應;沉淀滴定主要用于反應中產生沉淀的反應;酸堿滴定主要用于酸性物質與堿性物質的反應或者廣義上的路易士酸堿;絡合滴定主要用于絡合反應的滴定。
1、氧化還原滴定法
氧化還原滴定法是以氧化還原反應為基礎的容量分析方法。它以氧化劑或還原劑為滴定劑,直接滴定一些具有還原性或氧化性的物質;或者間接滴定一些本身并沒有氧化還原性,但能與某些氧化劑或還原劑起反應的物質。應用較為廣泛的有:碘量法、溴量法、鈰量法、亞硝酸鈉法、高錳酸鉀法和重鉻酸鉀法等。
2、絡合滴定法
絡合滴定分析方法,又稱配位滴定,是以絡合反應 (形成配合物)反應為基礎的分析方法。絡合反應廣泛地應用于分析化學的各種分離與測定中,許多顯色劑、萃取劑、沉淀劑和掩蔽劑等都是絡合劑。
3、酸堿滴定法
強酸和強堿在溶液中是完全離解的,酸以H+形式存在,堿以OH-形式存在。酸堿滴定法是以酸、堿之間質子傳遞反應為基礎的一種滴定分析法,可用于測定酸、堿和兩性物質。其基本反應為
H+ + OH- = H2O
該方法也稱中和法,是一種利用酸堿反應進行容量分析的方法。用酸作滴定劑可以測定堿,用堿作滴定劑可以測定酸,這是一種用途極為廣泛的分析方法。
4、沉淀滴定法
沉淀滴定法是利用沉淀反應進行容量分析的方法。生成沉淀的反應很多,但符合容量分析條件的卻很少,實際上應用最多的是銀量法。
四種滴定分析方法的異同點:
1、共同點
1) 都是以消耗計算量的標準物質來測定被測物質含量的。
2) 隨著滴定劑的加入,被滴定物質的濃度在計量點附近會有突變(突躍),可以用這一突變,或通過這一突變導致指示劑的變色來制定滴定終點。
3) 滴定分析終點誤差Et的定義都可以表示為:
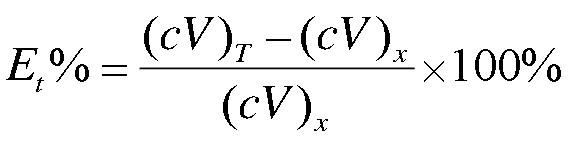
4) 由于歷史遺留問題四者使用的常數不同,若都用滴定常數Kt,可使四種滴定數學處理趨于一致。
2、不同點
1) 強酸強堿的滴定產物為水,從滴定未開始到滴定結束,H20一直是一個常數,約為55.5mol/L。
2) 沉淀滴定有異相生成隨著滴定的進行,一旦有沉淀生成他的活度就被制定為1,并且保持不變。
3) 絡合滴定產物ML的濃度在滴定過程中是一變數開始時為0,隨著滴定的進行,ML的濃度近線性的增大,直至化學計量點。
4) 最簡單的氧化還原反映的滴定產物有兩種,他們在滴定過程中的濃度變化與絡合滴定產物ML相似。所以從這一意義上,可把滴定分析分為兩種,一種是滴定產物的濃度為常量的,如強酸強堿滴定、沉淀滴定;一種是產物為變數的,如絡合和氧化還原滴定。




